
MECANISMOS DE CATÁLISIS ENZIMÁTICA.
1a. LISOZIMA: mecanismo químico de catálisis
Regresar a la página de estructura del sitio activo de la lisozyma

El sustrato consisten en un polímero alternado de Nacetil glucosamina (NAG) y n acetil-murámico (NAM)
Como se muestra arriba, la hidrólisis se inicia con la ruptura del enlace O-C por catálisis ácida, a partir de lo cual se forma un ión carbónio.
Luego de la salida del producto (alcohol), el ión carbonio reacciona con un hidroxilo que realiza un ataque nucleofílico regenerando el hemiacetal correspondiente.
La formación del hidroxilo ocurre en el sitio activo a partir de una molécula de agua que piede su protón por acción de la base conjugada del mismo aminoácido que realizó la catálisis ácida inicial, con esto el aminoácido recupera su protón y el oxígeno del agua se convierte en un nucleófilo muya activo.
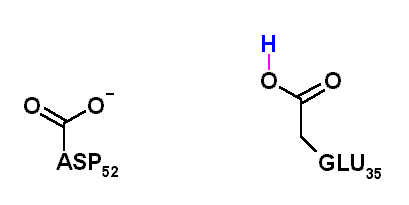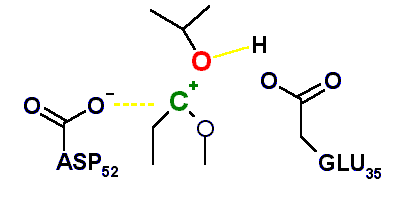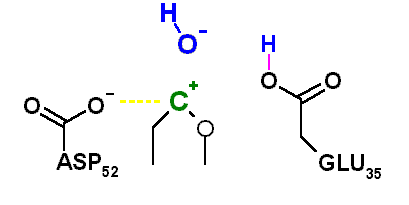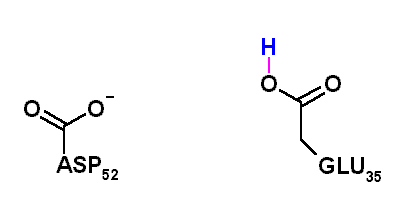
El aminoácido encargado de realizar catálisis ácida sobre el acetal y catálisis básica sobre el agua es el glutámico 35. Por otra parte, el aspartico 52 (53 en la lizosima humana), que posee un pKa más bajo se encuentra ionizado al pH óptimo y su carga negativa permite estabilizar el ión carbonio intermediario. Cuando el ASP 52 fue "mutado a GLU", la enzima se volvió 1000 veces más lenta, posiblemente debido a que su mayor cercanía al ión carbonio permite la formación de un aducto covalente que se libera muy lentamente del sitio activo.
Revisar la estructura de la lisozima en le PROTEIN DATA BANK
En la estrutura mostrada, el aspártico catalítico es el 53 y está covalentemente unido a un agente inactivante. Por su parte el glutamico catalítico es el 36. Haciendo click en la secuencia de ariba puede resaltar el aminoácido de interés.