Estructura de las Proteínas.
FUERZAS BÁSICAS QUE ESTABILIZAN LA ESTRUCTURA
TRIDIMENSIONAL DE LAS PROTEÍNAS.
Enlaces químicos
Enlaces
iónicos.
Enlaces
covalentes.
Fuerzas débiles
intermoleculares.
Fuerzas de Van
de Walls.
Enlaces o
puentes de Hidrógeno.
Interacciones
electrostáticas o puentes salinos.
Interacciones Hidrofóbicas.
Los enlaces químicos
La teoría atómica moderna, basada en
los principios de la mecánica cuántica, establece que
los electrones que forman parte de un átomo se encuentran
distribuídos en regiones del espacio que "rodean" a
los núcleos, estas regiones presentan formas singulares y son
llamadas orbilates atómicos. Estos pueden estar llenos (2
electrones), parcialmente llenos (1 electrón) o vacíos.
De entre estos orbitales, aquellos más exteriores llamados
capa de valencia, corresponden a niveles energéticos más
bajos. Por lo tanto, los electrones dela capa de valencia de un átomo
pueden saltar "fuera" del átomo, tanto como otros
electrones ajenos pueden caer en los dominios del átomo
ocupando orbitales vacíos o completando los parcialmente
llenos. Debido a que los orbitales semivacíos poseen una
elevada cantidad de energía libre, los átomos tienden a
reacomodar sus electrones de modo que los orbitales queden llenos o
vacíos, pero raramente, permanecerán semillenos. En
teoría, la tendencia de los átomos a completar la
capacidad total de electrones en la capa de valencia explica, en gran
medida, las capacidades de los átomos para combinarse unos con
otros. De hecho los átomos (y las moléculas) con
orbitales semillenos se conocen como radicales libres y son
"peligrosamente" reactivos, ya que cuando se acumulan en
una célula, pueden fácilmente dañarla
irreversiblemente.
|

|
|
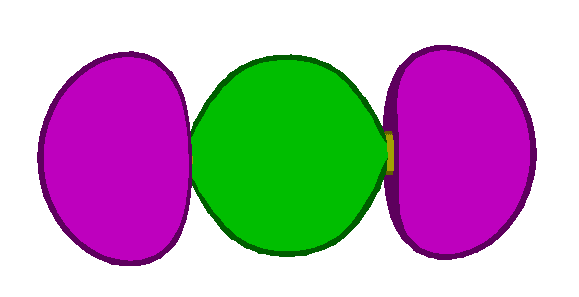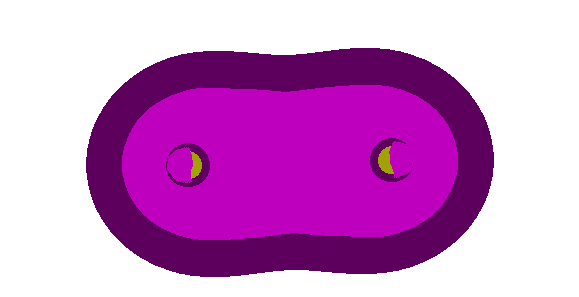
Imagen de la distribución aproximada de los 4
orbitales atómicos externos de un átomo de Neon.
Un orbital atómico s (esfera central rosa) y tres
orbitales tipo p en las tres direcciones del espacio (según
los ejes x, y y z). Cada orbital contiene 2
electrones (con diferente spin).
En la teoría de orbitales moleculares, estos
orbitales pueden combinarse para formar diferentes tipos de
orbitales híbridos.
|
|
|
|
La molécula del fluor: Los dos orbitales atómicos semivacíos
del fluor se combinan para formar 2 orbitales híbridos
uno de enlace (lleno) y otro de antienlace (vacío).
Los orbitales se distribuyen en el espacio
orientandose de modo que se evite la superposición, así,
la geometría final es lineal, pero en moléculas más complejas
puede ser planar rectangular, tetrahédrica,etc.
|
Como siempre, existen excepciones a esta regla y
algunas moléculas pueden permanecer con orbitales semillenos
sin ser tan reactivas. En este caso, la molécula de oxígeno
puede ser un buen ejemplo, ya que posee dos orbitales semillenos
(estado que se denomina triplete) y cuando por diversas reacciones
para a su esta de un orbital vacío y otro lleno se conviert en
una especia mucho más reactiva (estado singulete).
La teoría de orbitales moleculares establece
que dos orbitales atómicos semillenos, pertenecientes a dos
átomos individuales, pueden recombinarse. La recombinación
genera un orbital totalmente lleno y otro totalmente vacío y
en el proceso hay liberación de energía; es decir, se
trata de un proceso energéticamente favorable. Esto puede
ocurrir de diferentes maneras y es la base de la formación
de enlaces químicos.
El enlace iónico.
El reacomodo de dos orbitales atómicos
semillenos puede darse de tal modo que el orbital atómico de
menor energía quede lleno y dicho átomo portará
un electrón extra, lo que le confiere una carga
negativa (un anión). El segundo átomo quedará
entonces con deficiencia electrónica al poseer un orbital
vacío y portará una carga
positiva (un catión).
Dos átomos con carácter iónico
o iones (un anión y un catión) pueden permanecer unidor
en virtud de la atracción electrostática que se
establece entre ambos, al poseer carga opuesta. Decimos entonces que
se ha formado un enlace iónico. Este tipo de enlaces se
presentan comunmente en los cristales de compuestos salinos como
el cloruro de sodio y se conocen también como puentes salinos
o interacciones electrostáticas.
Como se verá más adelante, los enlaces
iónicos pueden debilitarse en ciertos medios, dando lugar a
iones independientes. Los iones pueden interactuar entre si, pero
debido a la naturaleza del medio, esta inteacción será
débil y por tanto se describirá en el apartado
correspondiente a las Interacciones
electrostáticas o puentes salinos.
Enlaces covalentes.
Otra manera de recombinar los orbitales consiste en
la formación de dos orbitales compuestos que ya no formen
parte de un átomo en particular. Estos orbitales se encuentran
entre los dos núcleos y su mera existencia requiere que los
núcleos de ambos átomos guarden una estrecha
cercanía. El resultado es la formación de
orbitales compartidos y el enlace formado se denomina covalente.
Los orbitales resultantes poseen al ocuparse diferente nivel energético, por
lo que quedan uno lleno (orbital de enlace, con
energía más baja que los orbitales atómicos originales) y el
otro vacío (orbital de antienlace, con
energía más alta que los orbitales atómicos originales) y ambos se distribuyen mayoritariamente
entre los dos átomos involucrados.
Los enlaces covalentes son muy fuertes y su
estabilidad poco se afecta por la presencia de solventes. Un ejemplo
típico de enlace covalente es el enlace Carbono-Carbono que se
presenta en gran número de compuestos orgánicos.
En la práctica, los orbitales compartidos no
se encuentran repartidos de manera equivalente, ya que los átomos
más electroatractores (electronegativos) tienden a mantener a
los electrones en su cercanía y, por lo tanto, el orbital
molecular de enlace presenta mayor volumen en la vecindad del átomo
electronegativo. Los enlaces covalentes en los que ambos átomos
participantes poseen una electronegatividad semejante (como en los
enlaces C-C), no presentan diferencias en la carga electrónica
a lo largo de la molécula, por tanto su carga eléctrica
es también unforme y se dice que carecen
de polaridad (en realidad su momento dipolar es pequeño, raramente es nulo).
Sin embargo, en muchos casos el enlace covalente se
forma entre átomos de distinta electronegatividad y en
consecuencia los electrones se agrupan más cerca de aquel
átomo electronegativo, como consecuencia un lado de la
molécula es electrodeficiente (posee carga parcial positiva) y
el otro es electrodenso (posee carga parcial negativa). Este tipo de
enlaces se designan como enlaces covalentes
polares y las moléculas con este desbalance de cargas
se designan como dipolos.
Fuerzas intermoleculares.
Las moléculas con caracter dipolar, al igual
que los iones, pueden interaccionar con otra moléculas
dipolares al atraerse electrostáticamente entre sí. Sin
embargo, la fuerza de esta interacción nunca alcanzará
a la de un enlace iónico (en el vacío). Podría
decirse que los enlaces iónicos son el caso más extremo
de un enlace covalente polar.
Un ejemplo clásico de una molécula
dipolar con enlaces covalentes polares es la molécula del
agua. El agua es un claso clásico de una substancia que
permanece en estado líquido gracias a la gran cohesividad
entre sus moléculas. Esta atracción se explica por la
notable polaridad de la molécula y por la regularidad
geométrica de las uniones agua-agua que forman una compleja
red tridimensional, a pesar de tratarse de enlaces débiles,
podemos aplicarles el viejo dicho zapatista "muchacos, no
somos machos, pero somos muchos".
Las interacciones entre moléculas de
diferente grado de polaridad o carga eléctrica da lugar a
fuerzas de atracción intermolecular, que por su baja
estabilidad y corta duración se designan como interacciones
débiles. De acuerdo con el tipo de moléculas que
participan y con las características específicas de la
interacción, estas fuerza débiles reciben distintos
nombres.
Interacciones
electrostáticas o puentes salinos.
Las interacciones electrostáticas pueden
debilitarse cuando otros iónes diferentes se encuentran en la
cercanía, modificando el campo eléctrico, o bien,
cuando los iones se disuelven en un solvente capaz de rodearlos y
apantallar las cargas eléctricas (solvente áltamente
dieléctrico, propiedad que caracteriza a la cinta de aislar).
Un solvente con esta caraterística es el agua y por ello, los
enlaces iónicos, de gran fuerza en un cristal de sal, se
vuelven débiles en una masa de acuosa y la sal se
disuelve.
Muchas moléculas que poseen enlaces
covalentes de gran polaridad pueden, en solventes altamente
dieléctricos (como el agua), reorganizar la compartición
de electrones para dar lugar a dos iones. Como estos iones son
rápidamente rodeados de moléculas de agua, lejos de
permanecer unidos, se separan y permanecen independientes en la
solución. El proceso es, por supuesto, reversible y dos iones
afines pueden reaccionar para regenerar el enlace covalente. De nuevo
un ejemplo de esto es el agua, cuya reacción de disociación
es bien conocida.
A pesar de que los iones en una solución
acuaso tienden a permanecer solvatados y por lo tanto sólo
interaccionan brevemente, en moléculas en las que el ión
está encerrado en regiones de la molécula que tienen
poco contacto con el agua, estos iones buscarán un ión
de carga opuesta para formar un puente salino, siempre que los iones
puedan acecarse lo suficiente.
En muchas proteínas, el balance de zonas
polares y no polares obliga al polímero a adoptar una
estructura de tipo globular en la que extensas regiones de la
proteína se encuentran escondidas del agua (gracias a las mal
llamadas interacciones hidrofóbicas). En estas regiones los
puentes salinos poseen gran importancia para mantener la estabilidad
de la conformación de la proteína. Por supuesto,
cualquier condición que provoque la exposición de las
regiones interiores de la proteína, permitirá la
solvatación de los iones y la ruptura de los puentes salinos.
Fuerzas de Van de Walls.
Las fuerzas de Van de Walls son las interacciones
más débiles entre las fuerzas débiles. Su
existencia es casi siempre transitoria y el hecho de que puedan
explicar la cohesividad de ciertos solventes y sólidos, tales
comola gasolina yla parafina, sólo puede comprenderse cuando
se cuantifica el enorme número de interacciones de este tipo
que pueden ocurrir en el seno de la masa la substancia en cuestión.
Las fuerzas de Van der Walls incluyen a un número
significaivo de interacciones que ocurren entre moléculas, o
regiones moleculares unidas por enlaces covalentes de baja o nula
polaridad. Contra lo que pudiera esperanse, las fuerzas de Van de
Walls si poseen un componente electrostático, además de
otros efectos electroactractores que se explican mediante la mecánica
cuántica. Obviamente, la atracción electrostática
débil de dos regiones de una molécula que poseen un
pequeño, pero apreciable, caracter dipolar, se incluye en
estas fuerzas. Pero además, a pesar de que un enlace covalente
sea totalmente apolar, esto no significa que los electrones estén
permanentemente repartidos de modo unifrome dentro de su orbital
molecular. Es perfectamente lógico esperar que, dada la gran
movilidad de los electrones, estos pueden quedar por un instante
cargados en un lado de la molécula. En ese instante, la
molécula adquiere caracter dipolar y esto se conoce como un
dipolo instantáneo.
Cuando dos regiones moleculares apolares se
encuentran suficientemente cerca, los dipolos instantáneos o
los dipolos débiles que aparecen en una de ellas producen un
campo eléctrico, el cual induce, a su vez, una
distribución inequitativa de los electrones, con dirección
opuesta al dipolo que originó el desbalance. El dipolo que se
genéra por este método se conoce como un dipólo
inducido. Aún cuando la duración de un dipolo
instantaneo y su correspondiente dipolo inducido es corta, la
cercanía de ambos produce que los electrones de los orbitales
moleculares involucrados mantengan una cierta sincronía al
moverse, en consecuencia, la carga oscila sincrónicamente
manteniendo las fuerzas electroatractoras por tiempos más
prolongados que los que podría durar un dipolo instantáneo
(del orden de 10-15s).
Debido a que la existencia de las fuerzas de Van de
Walls depende de la proximación de dos moléculas, la
fuerza del enlace será mayor si al aproximarse ambas moléculas
se producen múltiples contactos entre ellas. Para que dos
moléculas que se aproximan puedan establecer suficientes
contactos entre ellas, se requiere que sus geometrías sean
complementarias; es decir, que encajen de manera similar a una pieza
de plástico y el molde en que se formó.
Las interacciones intermoleculares basadas en la
atracción electrostática serán más
fuertes entre aquellas moléculas que posean mayor caracter
dipolar. Evidentemente, dos moleculas con marcado caracter dipolar
podrán establecer interacciones más estables entre si,
que con otras moléculas apolares. La preferencia a interactuar
entre si es lo que explica aquella famosa regla que dice "lo
semejante disuelve a lo semejante". Es decir polar prefiere a lo
polar y lo no polar será segregado, en consecuencia las
moléculas no polares se ven forzadas a interactuar entre si.
La complementariedad geométrica es una de las
razones por las que las macromoléculas biológicas y
especielmente las proteínas, son capaces de interaccionar
selectivamente con otras moléculas. En realidad todas las
moléculas interaccionan entre si, lo sorprendente de las
proteínas es su habilidad para interaccionar con gran
fuerza con una cierta molécula, al tiempo que son
incapaces de establecer una interacción duradera con moléculas
muy similares a la primera.
Enlaces o puentes de Hidrógeno.
Entre los enlaces que generan un mayor caracter
dipolar, sin que necesariamente se llegue al estado iónico, se
encuentran aquellos que son fomados por un átomo
electronegativo y el hidrógeno. Por ser el átomo más
pequeño, el único electrón en su capa de
valencia ocupa un nivel cercano al núcleo y cuando el electrón
es redistruibuído hacia el átomo electronegativo (O, N,
S) el dipólo resultate es muy marcado. Adicionalmente, debido
a su pequeño radio atómico el hidrógeno permite
una mayor proximidad entre las moléculas. Por ello, de entre
todas las interacciones electrostáticas que no involucran la
formación de iones, aquellas en las que participa el hidrógeno
son las más fuertes.
Para que un puente de hidrógeno se forme se
requiere de una molécula que posea un hidrógeno unido a
un átomo de elevada electronegatividad y otra molécula
que posea otro átomo electronegativo con alta densidad
electrónica (es decir carga parcial negativa). Cuando ambas
moléculas se aproximan por el hidrógeno, se genera un
enlace débil denominado puente de hidrógeno. En un
puente de hidrógeno la molécula que posee el hidrógeno
que participa en el puente se denomina donadora y aquella que porta
el átomo electronegativo complementario se denomina aceptora.
Una misma molécula puede actuar como donadora y aceptora
formando dos o más puentes de hidrógeno
simultáneamente. Tal es el caso de las moléculas de
agua.
A pesar de ser un enlace débil, el pueste de
hidrógeno puede llegar a alcanzar una energía
equivalente a 1/10 de la contenida en los enlaces covalentes C-C, por
ello, se les considera los más fuertes de entre los enlaces
débiles.
La fuerza del puente de hidrógeno depende
también de varios factores, a saber: la electronegatividad de
los átomo donador y aceptor, la polaridad del medio
circundante, la orientación de los tres átomos X-H:Y en
una misma línea y la distancia entre el donador y el aceptor.
El agua es una de las moléculas que puede
formar puentes de hidrógeno con gran facilidad con otra
moléculas de agua vecinas. Además, debido a que
establece dos puentes de H como donadora y dos como aceptora de un
hidrógeno, el balance de grupos donadores, respecto de los
aceptores disponibles en el agua se encuentra debidamente compensado
y a diferencia de lo que sucede en el H-F o el NH3, no hay
exceso ni de unos, ni de otros. Así es posible explicar que
los datos experientales indiquen que una molécula de agua se
encuentra formando en promedio 3.6-3.7 puentes de hidrógeno a
temperatura ambiente. Esto significa que extraer una mol de agua de
la fase líquida al vació cuesta 5X3.6=18 Kcal. Esto es
casi la tercera parte de lo que cuesta romper ciertos enlaces
covalentes.
En una solución acuosa, casi cualquier
molécula capaz de formar un puente de Hidrógeno tenderá
a establecer dicha unión con moléculas de agua. Esto no
debe sorprendernos, ya que la cocentración del solvente
siempre supera con mucho a la concentración de los solutos en
soluciones diluídas; e inclusive, en soluciones no tan
diluídas. Quízá sólo cuando la
concentración de soluto es realmente elevada, es que podemos
esperar que las moléculas de soluto puedan interacccionar
entre sí.
Entonces - ¿cómo es posible que las
moléculas proteína en solución puedan establecer
puentes de hidrógeno intramoleculares (entre los grupos de una
misma moléculas) e intermoleculares? - es decir, uniones
consigo misma o con otros ligandos, incluyendo a otras
macromoléculas, tales como otras proteínas, ácidos
nucléicos, carbohidratos, etc.
Bueno, esto es posible gracias a dos características
de la proteína:
Dado que ambos grupos químicos son parte
de la misma molécula, a pesar de que se encuentran diluídos,
se mueven juntos. Esto significa que al moverse se encontrarán
uno frente a otro más frecuentemente de lo sucedería
si fuesen parte de otra molécula.
Pero además, la naturaleza amfipática
de una proteína hace que las distintas regiones de la
molécula presenten mayor o menor polaridad, de manera que si
en una región en la que predominan restos de aminoácido
apolares queda encerrado el grupo polar de una serina (-CH2-OH)
o una glutamina (-CH2-CH2-CONH2).
La región apolar que muy posiblemente quedará
escondida del solvente (ver apartado siguiente),
forzará al residuo polar a buscar en las cercanías un
vecino con el que formar un puente de hidrógeno, esto casi
siempre resulta posible, porque habrá que recordar que los
enlaces peptídicos pueden formar puentes de hidrógeno
y en una proteína siempre hay tantos enlaces peptídicos
como aminoácidos menos 1.
En general, diversos experimentos han demostrado que
el esqueleto de una proteína (-N-Ca-CO-N-
Ca-) posee una
polaridad bastante pobre en comparación con el agua, por lo
que en general, tenderá a esconderse del agua a menos que las
cadenas laterales de los aminoácidos le indiquen otra cosa.
Interacciones Hidrofóbicas.
Quizá una de las interacciones que crean más
confusión entre quienes desean aprender bioquímica, son
las, en mi opinión mal llamadas, interacciones hidrofóbicas
-Es sorprendente, sin embargo, que la mayoría de los
estudiantes de química, aún en los semestres iniciales
manejen con naturalidad el concepto de que lo semejante disuelve a lo
semejante- Así, la mayoría de los estudiantes con los
que he tenido la fortuna de tratar, ven con buenos ojos la
asevaración de que las moléculas apolares tienen poco
"gusto" por el agua y "prefieren" interaccionar
con otras moléculas "de su clase".
¡Bien, pues nada más falso! - Las
moléculas apolares son tales, porque carecen de enlaces con
una distribución desigual de electrones entre los núcles
de los átomos que forman el enlace y, por consiguiente,
interaccionan unas con otras a traves de las ya descritas fuerzas
de Van de Walls. Como dijimos en dicho capítulo, la
atracción entre una molécula polar y una molécula
apolar será casi siempre mayor que entre dos moléculas
apolares y, es de esperarse, que el agua interaccione con un
hidrocarburo como el isooctano (gasolina) con mayor fuerza de lo que
dos moléculas de iooctano interaccionan entre si ... ¿Por
qué entonces las moleculas de isoctano no se disuelven del
agua y ambos solventes tienen a separarse?
La explicación al dilema anterior está
en un hecho muy simple, las moléculas de agua en el grueso del
cuerpo de agua mantienen múltiples interacciones con las
vecinas a través de una extensa red de puentes
de Hidrógeno y, como es de esperarse, la interacción
agua-agua, mediada por puedes de hidrógeno, es casi 10 veces
más fuerte que la interacción agua-hidrocarburo.
Además, por su geometría, a fin de mantener el máximo
número de enlaces agua-agua entre sí, las moléculas
de agua que rodean a una molécula de isooctano en solución
deben adoptar una estructura quasiordenada, lo que va en contra de la
tendencia natural de los moléculas de mantener tanta libertad
como les sea posible.
En resumen, "El agua prefiere interaccionar con
agua y tiende a excluir de su cercanía a aquellas moléculas
que no son agua"; como resultado de lo anterior, "los
solutos apolares son excluídos de la solución y tienden
a agruparse entre ellos, lo que reduce la superficie de contacto
entre el agua y el hidrocarburo". En el núcleo de las
"gotas" de hidrocarburo, las moléculas apolares
deberán, a falta de otra opción, interaccionar entre sí
al igual que la hacen en el hidrocarburo líquido puro.
Macroscópicamente sin embargo, nosotros observamos un
comportamiento tal que pareciese que el hidrocarburo e separase del
agua por voluntad propia e invocamos el término "interacciones
hidrofóbicas", pero que podrían describirse mejor
como "interacciones favorecidas por la exclusión debida a
la entropía del solvente (IFEDES; Interaction favoured by
entropically-driven exclusion from the solvent)"
Al margen de como les llamemos, estas interacciones
son quizá la fuerza de mayor influencia en la estabilidad de
la estructura de las proteínas, ya que como se mencionó,
no es factible entender la formación de puentes de hidrógeno
e interacciones iónicas intramoleculares en un medio
totalmente acuoso, a menos que extensas regiones de la macromolécula
tengan una exposición limitada al cuerpo del solvente.

