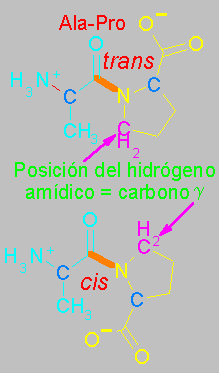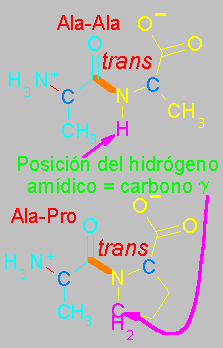
Debido a que la cadena lateral de la prolina forma un ciclo de 5 átomos con su propio grupo amino, cuando el grupo amino de la prolina forma un enlace peptídico con otro aminoácido, el enlace peptídico resultante no posee un hidrógeno amídico. El lugar que en otros enlaces peptídicos ocupa dicho hidrógeno es ocupado aquí por el carbono g.

Una consecuencia importante de esta diferencia estructural es que en un enlace peptídico trans convensional, el carbono a del primer aminoácido queda del mismo lado del enlace que el nitrogeno amídico del segundo aminoácido. Pero un un peptido X-Pro, este carbono a queda enfrente del carbono g de la prolina. De manera que los impedimentos de tipo estérico que se producen en un enlace trans son semejantes a los que se observan en el enlace cis, en el que los carbonos a quedan enfrentados.