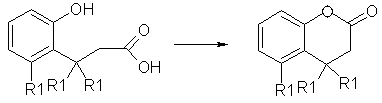
EJERCICIOS DE TAREA PARA LOS ALUMNOS DE BIOQUÍMICA I DE LICENCIATURAS EN Q.F.B. Y Q.A. DE LA FACULTAD DE QUÍMICA DE LA UNAM.
Problemas sobre purificación de proteínas.
Problemas sobre el comportamiento cinético de las enzimas.
Problemas sobre mecanismos de catálisis.
Solución a los problemas sobre purificación de proteínas.
Solución a los problemas sobre el comportamiento cinético de las enzimas.
Solución a los problemas sobre los mecanismos de catálisis.
Esta sección contiene 7 problemas.
----------regresar al índice general------------
La siguiente tabla indica los pesos moleculares y el valor del punto isoeléctrico de varias proteínas a las que se hace referencia en los problesmas de esta sección.
Tabla 1. Propiedades fisicoquímicas de algunas proteínas.
|
Nombre de la proteína |
pI |
P.M. (kd) |
|
|
|
|
|
Ovoalbúmina |
4.5 |
45 |
|
Seroalbúmina (humana) |
4.9 |
69 |
|
Ureasa (Canavalis enziformes) |
5 |
483 |
|
ß-lactoalbúmina (cabra) |
5.2 |
37 |
|
g-Globulina |
6.6 |
120 |
|
Hemoglobina (Humana) |
6.8 |
65 |
|
Mioglobina (corazón de equino) |
7 |
17 |
|
Quimitripsinógeno (Bovino) |
9.6 |
23 |
|
Citocromo c (corazón de Bovino) |
10.65 |
13 |
|
Lisozima |
11 |
nd |
|
Virus del Mosaico del tabaco |
nd |
40,590 |
|
Catalasa (rábano) |
nd |
222 |
|
Aldolasa |
nd |
149 |
|
Miosina (Bacalao) |
nd |
525 |
|
Fibrinógeno (humano) |
nd |
340 |
1.- La siguiente lista de reactivos incluye muchos compuestos que se emplean normalmente para investigar la estructura y propiedades de las proteínas:
CNBr Azul de Coomasie 6N.HCl @ 90°C
b-mercaptoetanol Ninhidrina Tripsina
Fenilisotiocianato Quimotripsina dodecil sulfato (SDS)
Acril/Bisacrilamida Iodoacetamida o ácido perfórmico
Elija de esta lista los reactivos que emplearía en los siguientes casos y diga cómo emplearía cada uno de ellos para dicho propósito.
a) Se desea determinar el peso molecular de las subunidades de una proteína mediante un técnica electroforética.
b) Se desea cortar una proteína en fragmentos pequeños para poder estudiarla.
c) Se desea degradar una polipéptido de la proteína en sus componentes aminoacídicos para luego analizar la proporción que la cadena estudiada contiene de cada uno de ellos.
d) Se desea obtener la secuencia de aminoácidos de uno de los péptidos obtenidos a partir de la digestión de una proteína.
----------Regresar al índice de la sección -------------------regresar al índice general------------
2.- En una electroforesis desnaturalizante (según Laemmli) se obtuvieron las movilidades relativas siguientes:
Ovoalbúmina, 0.39; b-lactoalbúmina, 0.46; Mioglobina, 0.66; Lisozima, 0.58.
De acuerdo con los datos de la tabla 1 calcule el peso molecular de la lisozima.
3.-Un investigador estaba tratando de purificar la acetilcolinesterasa de cerebro de rata por medio de diversas técnicas. Él reportó sus datos en la siguiente tabla pero omitió calcular algunos valores útiles.
|
Paso de purificación |
Actividad total (µmol/min) |
Proteina total (µg) |
|
Homogenizado de tejido fresco. |
556.7 |
33,340.0 |
|
Precipitación con (NH4)2SO4 |
556.7 |
1,070.0 |
|
DEAE-celulosa |
289.5 |
124.0 |
|
concentración y díalisis |
278.4 |
115.0 |
|
sephadex-G200 |
233.8 |
56.0 |
|
Cellex-P (intercambio catiónico) |
139.2 |
55.4 |
|
DEAE-celulosa |
89.1 |
11.3 |
|
DEAE-sephadex |
66.8 |
11.1 |
|
cromatografía de afinidad |
46.8 |
4.8 |
a) Complete la tabla agregando las columna de actividad específica y el rendimiento obtenido luego de cada paso de la purificación.
b) Analize los resultados de la tabla y, tomando en cuenta aquellos pasos que no contribuyeron a la purificación, sugiera mejoras al procedimiento.
c) explique el razonamiento que apoya sus propuestas.
----------Regresar al índice de la sección -------------------regresar al índice general------------
4.- A que pH sería más eficaz una electroforesis nativa (sin desnaturalizantes) de las siguientes mezclas de proteínas: a) Seroalbúmina y Hemoglobina; b) mioglobina y quimotripsinógeno; c) ovoalbúmina, seroalbúmina y ureasa (ver tabla 1).
----------Regresar al índice de la sección -------------------regresar al índice general------------
5.-Prediga la secuencia con la eluirían las siguientes proteínas de una columna de filtración en gel con un rango de exclusión de 5,000 a 400,000 daltones: Mioglobina, catalasa, citocromo c, miosina, quimotripsinógeno y seroalbúmina (ver tabla 1).
----------Regresar al índice de la sección -------------------regresar al índice general------------
6.- Calcule el peso molecular aproximado de la lisozima nativa a partir de los siguientes volumenes de elución obtenidos en la columna del problema anterior (ver tabla 1):
Citocromo c, 118; b-lactoalbúmina, 58; Hemoglobina, 24; Lisozima, 83 ml.
----------Regresar al índice de la sección -------------------regresar al índice general------------
7.- Con los datos de los problemas 2 y 7 ¿Qué puede decir acerca de la estructura cuaternaria de la lizozima? - Explique su respuesta.
----------Regresar al índice de la sección -------------------regresar al índice general------------
Esta sección contiene 11 problemas.
----------regresar al índice general------------
1-Orden de reacción. La enzima Glicerol-3 fosfato deshidrogenasa se inactiva irreversiblemente en presencia de ciclohehanediona con una cinética aparente de primer orden. Sin embargo, cuando se varía la concentración del agente inactivante en la cubeta se observa que la cinética se modifica. Explique este resultado calcule el valor real de la constante de velocidad de la reacción.
|
[CHD] (mM) |
0.2 |
1 |
|
t (min) ¯ |
Enzima activa |
remanente (%) |
|
0 |
100.0 |
100.0 |
|
10 |
92.2 |
77.8 |
|
20 |
93.9 |
56.8 |
|
30 |
88.4 |
46.3 |
|
40 |
76.2 |
36.6 |
|
60 |
72.1 |
20.4 |
|
90 |
60.8 |
9.1 |
|
120 |
54.6 |
4.3 |
Sugerencias:
a)Demuestre que la cinética de inactivación es de primer orden aparente y calcular la constante de primer orden y la vida media (no olvide las unidades).
b)Determine si la constante de primer orden varía con la concentración del reactante CHD y escriba una expresión para la velocidad que incluya a todos los reactantes.
c) A partir de esta ecuación identifique que es lo que varía en cada experimento y lo que se mantiene constante y diga porque la cinética aparece como si fuese de primer orden.
----------regresar al índice de la sección -------------------regresar al índice general------------
2 Ensayo actividad de una enzima. La enzima málico deshidrogenasa cataliza la reducción de oxaloacetato con NADH, a malato y NAD+. En el siguiente experimento se siguió la desaparición del NADH, midiendo su absorbencia a 340 nm (e = 6220 M-1 cm-1). Si se emplearon 35 ng de proteína de la preparación enzimática, en una cubeta de 3 mL, para este experimento, determine la actividad de la enzima en unidades internacionales y la actividad específica de esta preparación.
|
tiempo (min) |
0.00 |
0.10 |
0.20 |
0.30 |
0.50 |
0.85 |
1.50 |
2.00 |
|
Absorbencia |
1.34 |
1.28 |
1.26 |
1.22 |
1.16 |
1.10 |
1.02 |
0.99 |
----------regresar al índice de la sección -------------------regresar al índice general------------
3 Efecto de la concentración de enzima. En el siguiente experimento con la enzima fosfatasa ácida de semillas de trigo germinadas se varió la concentración de la enzima en cubeta a dos concentraciones de sustrato y se obtuvieron los resultados siguientes:
|
[enz] (ml) |
[FP] 0.1 mM |
[FP] 10 mM |
|
|
Vel (nmol/min) |
Vel (nmol/min) |
|
5 |
1.920 |
6.307 |
|
10 |
4.059 |
13.169 |
|
15 |
5.956 |
19.145 |
|
20 |
7.766 |
25.694 |
|
25 |
9.479 |
32.282 |
|
30 |
11.844 |
37.882 |
a) ¿Como varia la velocidad de la reacción en función de la cantidad de enzima añadida?
b) ¿Qué pasa si dividimos la velocidad registrada por la cantidad de enzima añadida al ensayo?
c) ¿Utilizando la ecuación de Michelis-Menten explique sus respuestas a las preguntas anteriores?
----------regresar al índice de la sección -------------------regresar al índice general------------
4-Cinética de una enzima. La actividad de la Acetil-CoA carboxilasa, medida con tres diferentes concentraciones de enzima y a diferentes concentraciones de sustrato fué la siguiente:
ï ¾¾¾¾¾¾¾¾®
|
[Enz] (mg de proteína) |
0.1 |
0.2 |
0.5 |
|
[AcetilCoA] (mM) ¯ |
|
Vel (mmol |
/ min) |
|
0.05 |
0.275 |
0.546 |
1.373 |
|
0.14 |
0.482 |
1.001 |
2.502 |
|
0.23 |
0.580 |
1.185 |
2.891 |
|
0.32 |
0.642 |
1.385 |
3.463 |
|
0.50 |
0.755 |
1.494 |
3.656 |
|
0.59 |
0.766 |
1.497 |
3.810 |
a) Calcular para cada experimento el valor de Km y el valor de Vmax.
b) ¿Son los valores de Km y Vmax iguales o diferentes?
c) Explique si lo que observó es lo que esperaba obtener
d) Sabiendo que la enzima pesa 220 000 grs/mol, haga una gráfica de Vmax vs mmol de enzima.
e) ¿Qué represnta la pendiente de esta gráfica?
f) ¿En qué se parece el valor anterior a la Actividad específica = Vmax/mg de proteína en mmol min-1 mg de enzima-1?
g) ¿Qué pasa con la medida de actividad específica cuando la enzima no está pura?
----------regresar al índice de la sección -------------------regresar al índice general------------
5-Problema sobre un ensayo de actividad enzimática. Considere a la enzima Invertasa, que cataliza la hidrólisis de Sacarosa a fructosa y glucosa. Esta enzima posee una Km para sacarosa de 0.5 mM y una constante catalítica de 175 min-1. Si se mide su actividad en presencia de 0.25 mM de sacarosa con 25 pmol de enzima en la cubeta - ¿qué velocidad de catálisis se observará? - ¿qué fracción representa esto de la Vmax que se podría calcular en esta reacción si se variase la cantidad de sacarosa? - ¿Cuánto sustrato habría que añadir para que la velocidad observada alcanzase 0.95% de la Vmax? - ¿Qué importancia podría tener esto para la posible aplicación industrial de la enzima? - Explique sus respuestas.
----------regresar al índice de la sección -------------------regresar al índice general------------
6-Problema sobre una reacción con dos sustratos.
La enzima Aspartato transaminasa, que cataliza la reacción:
Aspartato + Oxoglutarato ¾¾¾®Glutamato + Oxaloacetato
se realizaron los siguientes tres experimentos el siguiente experimento:
|
[Asp] = |
1 mM |
|
[OxG] = |
0.02 mM |
|
[OxG] = |
0.5 mM |
|
[OxG] |
Vel |
|
[Asp] |
Vel |
|
[Asp] |
Vel |
|
0.002 |
0.444 |
|
0.007 |
0.411 |
|
0.007 |
0.468 |
|
0.018 |
2.031 |
|
0.048 |
1.268 |
|
0.048 |
2.017 |
|
0.037 |
2.781 |
|
0.171 |
1.722 |
|
0.171 |
3.317 |
|
0.063 |
3.336 |
|
0.335 |
1.850 |
|
0.335 |
3.866 |
|
0.094 |
3.756 |
|
0.547 |
1.983 |
|
0.547 |
4.123 |
|
0.493 |
4.324 |
|
1.016 |
2.031 |
|
1.016 |
4.324 |
a) Calcule Km y Vmax para cada sustrato.
b) ¿Cambian las Vmax? Explique su respuesta
c) Explique que pasó en el segundo experimento, con respecto al tercero.
d) ¿Cúantos y cuáles valores de Km debo considerar para describir la afinidad de la enzima por sus substratos?
e) ¿Qué conclusión se podría sacar de esos datos?
----------regresar al índice de la sección -------------------regresar al índice general------------
7- Problema sobre la energía de activación.
Para la enzima catalasa se realizó un experimento en el que se determinó la velocidad de descomposición del peróxido de hidrógeno en ausencia ó en presencia de 10 nM de enzima en el ensayo.
|
T |
vel(sin catalasa) |
vel(con catalasa) |
|
(ºC) |
(mol/s) |
(mol/s con 10nM·Et) |
|
4 |
0.40E-08 |
0.0410 |
|
10 |
7.74E-09 |
0.0464 |
|
15 |
1.31E-08 |
0.0476 |
|
20 |
2.09E-08 |
0.0497 |
|
25 |
3.52E-08 |
0.0530 |
|
30 |
5.74E-08 |
0.0598 |
-Suponiendo que la concentración de peróxido de hidrógeno fue suficiente para garantizar la saturación de la enzima, calcular la energía de activación de la reacción con o sin enzima y discuta sus resultados. (R=1.987 cal/mol/ºK)
----------regresar al índice de la sección -------------------regresar al índice general------------
8-Efecto de temperatura sobre una enzima:
Los valores de Km y Vmax siguientes se determinaron midiendo la hidrólisis de bromuro de acetilcolina catalizada por la esterasa bovina a diferentes temperaturas:
|
T (ºC) |
KM (mM) |
kcat (mmol min-1 pmol_[E]t-1) |
|
20 |
0.403 |
0.307 |
|
25 |
0.375 |
0.322 |
|
30 |
0.335 |
0.340 |
|
35 |
0.305 |
0.362 |
|
45 |
1.500 |
0.013 |
a) ¿Qué intervalo de termperaturas deberían emplearse como datos para calcular la energía de activación de la reacción catalizada por la enzima?.
c) Para ralizar el cálculo anterior: ¿debería emplearse los valores de Km o de kcat.
b)-¿Por qué varía KM con la temperatura? (sugerencia: vea la deficinción de KM).
----------regresar al índice de la sección -------------------regresar al índice general------------
9- Efecto del pH sobre la Vmax. Los siguientes valores de velócidad inicial de enzimas fueron obtenidos para la a-Quimotripsina actúando sobre un sustrato artificial (ester etílico de acetil-L-triptofano):
|
pH |
Vel (unidades internacionales) |
pH |
Vel (ui) |
|
5.4 |
10 |
6.8 |
192 |
|
5.6 |
19 |
7.2 |
260 |
|
5.8 |
32 |
7.4 |
280 |
|
6.4 |
99 |
7.8 |
300 |
|
6.5 |
112 |
8.0 |
328 |
|
6.6 |
141 |
8.4 |
331 |
|
sigue |
en las columna 3 y 4. |
9.0 |
327 |
a) Determine los valores de pKa(s) del (los) grupo(s) involucrado(s) en este comportamiento.
b) Diga que residuos de aminoácido podrían responsables de esta respuesta.
c) Si el experimento se extendiera hacia la región más alcalina de la escala de pH que cabría esperar (explique su respuesta).
----------regresar al índice de la sección -------------------regresar al índice general------------
10-Problemas sobre inhibición:
Se realizaron estudios de inhibición para dos enzimas diferentes presentes en el suero bovino. Se varió la concentración de sustrato a en ausencia y en presencia de tres concentraciones diferentes de inhibidores de cada enzima. En cada caso encontrar:
a) El tipo de inhibición.
b) El valor de Km y Vmax.
c) El valor de Ki para el inhibidor.
Enzima: Fosfatasa alcalina de suero bovino, inhibidor: Oxalato de Bromolevamisol
ï¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾®
|
[Bromolevamisol] (mM) |
0 |
8 |
16 |
40 |
|
[Sustrato] ¯[FP](mM) |
Velocidades |
iniciales |
(mmol min-1 |
mgProt.-1) |
|
0.1 |
0.231 |
0.210 |
0.191 |
0.158 |
|
0.3 |
0.431 |
0.369 |
0.309 |
0.239 |
|
0.7 |
0.607 |
0.488 |
0.425 |
0.277 |
|
1.3 |
0.751 |
0.599 |
0.467 |
0.304 |
|
1.8 |
0.811 |
0.657 |
0.530 |
0.319 |
|
2.6 |
0.912 |
0.657 |
0.546 |
0.328 |
|
4.1 |
0.957 |
0.688 |
0.561 |
0.351 |
|
5.8 |
0.981 |
0.741 |
0.558 |
0.344 |
Enzima: Transaminasa Glutámico Pirúvica.
ï ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾®
|
[2hidroxisuccínico] (mM) |
0.0 |
1.0 |
2.0 |
5.1 |
|
[Sustrato] ¯[Glu](mM) |
Velocidades |
iniciales |
(mmol / min |
/ mgProt) |
|
0.6 |
0.59 |
0.48 |
0.38 |
0.24 |
|
1.4 |
1.12 |
0.91 |
0.78 |
0.51 |
|
2.9 |
1.63 |
1.43 |
1.19 |
0.87 |
|
5.2 |
1.94 |
1.70 |
1.64 |
1.19 |
|
8.0 |
2.19 |
1.94 |
1.94 |
1.56 |
|
10.3 |
2.28 |
2.06 |
1.99 |
1.74 |
|
16.0 |
2.32 |
2.33 |
2.24 |
1.89 |
|
25.1 |
2.62 |
2.53 |
2.25 |
2.09 |
----------regresar al índice de la sección -------------------regresar al índice general------------
El siguiente experimento fué realizado con la fosfoenolpyruvato:pyruvil tranferasa de streptococcus sp. Este enzima participa en la síntesis de la pared celular de las bacterias y cataliza la transferencia de un grupo piruvilo a un precursos del péptidoglicano, liberando fosfato. La fosfomicina (FSM) es un antibiótico sintetizado por ciertas bacterias del grupo streptomyces que inhibe a esta enzima. Usando el fosfoenolpiruvato (PEP) como sustrato a dos diferentes niveles de concentración, se estudió la inhibición de esta enzima por fosfomicina.
ï ¾¾¾®
|
[PEP] (mM) |
75 |
200 |
|
[FSM] (mM) ¯ |
Velocidad |
Velocidad |
|
0 |
0.73 |
2.49 |
|
5 |
0.53 |
2.29 |
|
10 |
0.42 |
2.15 |
|
25 |
0.26 |
1.78 |
|
50 |
0.16 |
1.4 |
|
100 |
0.09 |
0.98 |
a) Identifique el tipo de inhibición que se presenta
b) Calcule el valor de la I50 para este inhibidor a la concentraciones más baja y más alta de sustrato empleadas en el experimento.
b) ¿Qué diferencias observa entre este parámetro calculado con diferentes concentraciones de sustrato?
c) Suponga que encuentra reportados en la literatura otros inhibidores de esta enzima que actúan por un mecanismo semejante a este compuesto, pero descubre que en varios casos los autores emplearon diferentes concentraciones de PEP para estudiar el efecto del inhibidor. ¿Sería válido comparar los valores de KI reportados? - explique su razonamiento.
----------regresar al índice de la sección -------------------regresar al índice general------------
Esta sección consta de 7 problemas.
1.- El RNA se hidroliza rápidamente en solución alcalina. Sin embargo el DNA que carece del -OH en la posición 2'- del anillo furanósido de la ribosa es resistente a esta condición. Basado en su conocimiento del mecanismo químico de la RNAasa explique esta observación.
----------regresar al índice de la sección -------------------regresar al índice general------------
2. En la lactonización siguiente:
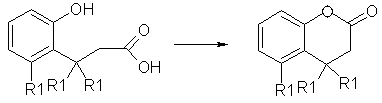
La reacción es 3.4 X 1011 veces más rápida cuando R1 es CH3 que cuando R1= H. Explique este resultado. ¿Cómo se relaciona lo anterior con los mecanismos de catálisis enzimática?
----------regresar al índice de la sección -------------------regresar al índice general------------
3.- Explique en términos termodinámicos porque una enzima que pueda estabilizar el complejo de Michaelis ES tanto como el estado de trasición ES#, no cataliza la reacción.
----------regresar al índice de la sección -------------------regresar al índice general------------
4.- Wolfenden afirma que carece de sentido distinguir entre sitios de unión y sitios catalíticos en una enzima. Discuta esta afirmación.
----------regresar al índice de la sección -------------------regresar al índice general------------
5.- Una dificultad grande al estudiar las proteasas pancreáticas es que, al ser ellas mismas proteínas. Son enzimas que se autodigieren. El problema es menos grave con la quimotripsina que con la tripsina. ¿Por qué?
----------regresar al índice de la sección -------------------regresar al índice general------------
6.- En la elaboración del Tofú, un preparado de la soya también llamado "queso de soya", se emplea un tratamiento que elimina el inhibidor de tripsina normalmente presente en los frijoles de soya, pero que, por lo demás, no afecta la apariencia, la textura o el sabor del producto.
a) ¿Qué hace necesario este proceso?
b) ¿Qué características cree usted que presenten las proteasas del aparato digestivo del Gorgojo de la soya?
----------regresar al índice de la sección -------------------regresar al índice general------------
7.- Para muchas enzimas, el mecanismo químico de acción implica catálisis ácida (donación de un protón) sobre un grupo y catálisis básica sobre otro. Si la enzima libre posee tanto a la base como al ácido, porqué estos no se neutralizan mutuamente.
----------regresar al índice de la sección -------------------regresar al índice general------------
Soluciones a los problemas en esta página