
La separación de mezclas de moléculas mediante la cromatografía de capa fina se basa en el principio del reparto entre dos fases. En general, una cromatografía se realiza permitiendo que la mezcla de moléculas que se desea separar (muestra) interaccione con un medio o matriz de soporte que se denomina fase estacionaria. Un segundo medio (la fase móvil) que es inmicible con la fase estacionaria se hace fluir a través de ésta para "lavar" (eluír) a las moléculas en la muestra. Debido a que las distintas moléculas en la muestra presentan diferente coeficiente de reparto, la fase móvil "lavará" a los distintos componentes con diferente eficiencia, de modo que aquellos que "prefieren disolverse" en la fase móvil serán eluídos más rápido que los que sean preferencialmente solubles en la fase estacionaria.
Para ilustrar esto, supongamos que tenemos una serie de vasos de precipitado llenos con agua hasta la mitad. Se añade al primero de los vasos una mezcla de las moléculas A y B. A posee una Kr(hexano:agua) de 0.9, en tanto que la Kr de B es 0.1. A continuación se añade un volumen de hexano al primer vaso, se agita, se permite la separación de las fases y se recupera dicho hexano. El hexáno recuperado en este primer vaso se añade al segundo y se añade más hexáno limpio al primer vaso. Ambos se agitan, se dejan separar las fases y se recupera el hexano. El hexano del segundo vaso se pasa al tercero el del primero al segundo y se anade hexano nuevo al primer vaso. Este procedimiento se repite hasta que todos los vasos se llenen con hexano.

Si nuestro experimento consistiese de 8 vasos, al final la cantidad de A y de B presente en cada vaso (sumando lo contenido en el hexano y el agua) presentará una distribución como la que se muestra en la gráfica siguiente.
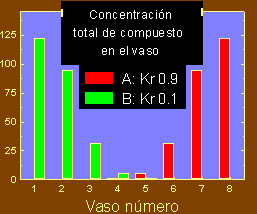
Si juntamos los vasos 1 al 3 por un lado y los vasos 6 al 8 por otro y evaporamos el solvente, habremos separado la substancia A de la B con una mínima pérdida (lo que se quedó en los vasos 4 y 5).
En la cromatografía de capa fina, la fase estacionaria es una delgada capa de un soporte sólido granulado, tal como gel de sílica, alumina, ácido silísico u otros, que se depositan sobre una placa de vidrio, aluminio u otro soporte inerte. Para que adquiera firmeza y no se desmorone, la capa de fase estacionaria se aglutina con una pequeña cantidad de sulfato de calcio u otro agente cementante. Las muestras se aplican añadiendo pequeñas gotas de solución en un pequeño circulo cerca del extremo inferior de la placa. La gota se deja secar y si se desea poner más muestra se pueden aplicar más gotas, cuidando de que la mancha no se haga demasiado grande.
La placa seca se sumerge en un pequeño volumen de fase móvil (mezcla de solventes). La polaridad de la mezcla de solventes se elige de acuerdo a la mezcla de compuestos que se desea separar.
En cromatografía de capa fina la fase estacionaria está hidratada, por lo que se le considera como la fase polar.
Como sólo la base de la placa queda sumergida, el solvente comienza a mojar la fase estacionaria y asciende por capilaridad. Al recorrer la placa la fase movil vá arrastrando a las substacias apolares y aquellas más polares son retenidas por la fase estacionario dando lugar a la separación.

La placa desarrollada se deja secar y se revela con un reactivo que tiña a las substancias de interés. La movilidad relativa o Rf es la relación entre la distancia recorrida por la mancha de un compuesto, dividida por la distancia recorrida por el frente de solvente al momento de sacar la placa del solvente.
En un sistema de TLC bien caracterizado, las substancias pueden identificarse comparando los valores de Rf con los de estándares, que se han analizado previamente o durante la chomatografía.
Si se desea, las substancias pueden recuperarse raspando la sílica de la placa del lugar en el que se detectó la mancha. Para ello, es necesrio emplear métodos de revelado que no destruyan a la muestra.
Las mezclas de aminoácidos pueden separarse en placas de capa fina de gel de sílica, empleando como fase móvil butano:agua:ácido acético (4:1:1). Las manchas de los aminoácidos pueden detectarse sobre la placa desarrollada, si después de secarla se asperja con una solución de ninhidrina.
Los aminoácidos aparecen como manchas púpura sobre un fondo ligéramente amarillento. Sin embargo, la prolina (que no pruduce amonio libre al reaccionar con ninhidrina) genera una mancha de color amarillo obscuro.
Este método, aunque no es muy sensible, se empleó con frecuencia en los primeros estudios de la composición de las proteínas. En la actualidad ha sido desplazado por la cromatografía líquida de alta resolución, ya que esta última es más confiable para la cuantificación y tiene mayor sensibilidad si los aminoácidos se detectan por fluorescencia.
Sin embargo, la cromatografía de capa fina se sigue empleando para determinar fosfoaminoácidos, ya que de esta manera es posible identificar si una determinada fosfoproteína, se encuentra fosforilada en serina, treonina o tirosina. Para ello, la proteína debe degradarse hasta liberar los aminoácidos que la componen y luego esto se separan en una placa de gel de sílica. La placa se gira 90o y se desarrolla con un segundo sistema de solventes. Los fosfoaminoácidos pueden revelarse con un reactivo de ácido fosfomolíbdico para permitir su identificación. Los sistemas en los que las plzcas se desarrollan en ambas direcciones (en este caso se aplica sólo una muestra por placa) se conocen como TLC bidimensional.
Regresar a las
separación |
|