
(regresar a la definición de aminoácido)
Propiedades de los α-aminoácidos
Propiedades ácido base
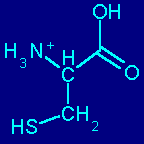
Dado que todos los aminoácidos poseen un grupo ácido (-COOH) y un grupo básico (-NH2), todos los aminoácidos libres presentan características ácido-base. Así, si nosotros titulamos un aminoácido como la glicina, observaremos lo siguiente:

cada punto de inflexion, indica la condición en que la forma ácida y la forma básica de un grupo químico son equimolares. El pH al que esto ocurre corresponde a:
-log (constante de ionización del ácido)
= pKA
(tal como lo indica la ecuación de Hendersson-Haselbach)
El primer grupo en titularse es el grupo ácido:
R-COOH -->R-COO- +
H+
el pKA aproximado de este grupo en los aminoácidos es cercano a 2.2 y es inferior al del ácido acético, esto debido al efecto electro-atractor del grupo α-amino, que a este pH se encuentra cargado positivamente.
El segundo grupo en titularse es el grupo α-amino:
R-NH3+ -->
R-NH2 + H+
que posee un pKA básico cercano a 9.8.
En varios aminoácidos, la cadena lateral también posee carácter ácido báse y por tanto tendremos un tercer grupo ionizable.
Estos grupos químicos son:
| Grupo | Aminoácido | Estructura | pKA |
| ε-amino | lisina (lys, K) |
|
10.53 |
| guanidio | Arginina (arg, R) |
|
12.48 |
| Imidazol | Histidina (his, H) |
|
6.00 |
| γ-carboxilato | Aspártico (asp, D) |
|
3.86 |
| δ-carboxilato | Glutámico (glu, E) |
|
4.25 |
| sulfhidrilo | Cisteína (cys, C) |
|
8.33 |
| fenol | Tirosina (tyr, Y) |
|
10.07 |
*carbono α
Estos aminoácidos presentan 4 especies iónicas distintas y sus curvas de titulación poseen tres puntos de inflexión. La posición del punto de inflexión adicional puede encontrarse en la porción central de la escala de pH (como en la histidina) o más allá del punto de titulación del grupo amino (como en la arginina).
Siempre que una molécula presenta dos o más grupos ionizables, existe un valor de pH al cual la especie iónica más abundante posee una suma de cargas positivas y negativas igual a cero, es decir, no posee carga eléctrica neta. Tal como ya se indicaba en la curva de titulación de la glicina.
Si nosotros analizamos el movimiento electroforético de los aminoácidos a distintos valores de pH, encontraremos un valor al cual su movilidad electroforética es nula. Este valor de pH corresponde a la condición en la cual la especie dominante es aquella que no posee carga eléctrica neta. Este valor de pH recibe el nombre de punto isoeléctrico (pI). El punto isoeléctrico puede calcularse como el valor promedio de los valores de pKA de los dos grupos siguientes:
El grupo ácido que al perder su protón da lugar a la especie
sin carga neta.
y
El grupo básico que al ganar un protón da lugar a la especie
sin carga neta.
¿Cuál será el pI de la cisteína? (pKa's 2.2, 8.33, 9.8)
Reactividad química
Los 20 L-α-aminoácidos naturales poseen un grupo ácido que puede sufrir las reacciones características de los ácido carboxílicos, por ejemplo:
 |
 |
También poseen un α-amino que el un nucleófilo reactivo y puede reaccionar con electrófilos, entre otros diversos compuestos carbonílicos, por ejemplo:
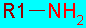 |
 |
Además de ello, los grupos R de los aminoácidos son diversos, por lo que pueden reacionar de varias maneras. Así, aminoácidos como al ácido aspártico y el ácido glutámico poseen un segundo ácido carboxílico, la lisina, posee un segundo grupo amino. Además, otros aminoácidos con grupos laterales reactivos son: la cisteína (-SH), la arginina (guanidio), la histidina (imidazol), la serina, la treonina y la tirosina (alcoholes), la asparagina y la glutamina (amidas), la metionina (un tioeter) y el triptofano (indol).
La reactividad de estos grupos funcionales ha sido aprovechada de diversas maneras en el estudio y análisis de la proteínas. Como un ejemplo, se menciona el caso de las lisinas, que reaccionan con aldehídos (carbonilo) para formar bases de shift, esto se ha aprovechado para producir un papel aldehídico, al que las proteínas se unen covalentemente, lo que permite fijarlas para su estudio (vease micro-secuenciación).
También es posible hacer reaccionar las cisteínas o las lisinas con diversos grupos químicos reactivos presentes en resinas, con lo que es posible unir proteínas a materiales para columnas de cromatografía y fabricar columnas con enzimas inmovilizadas, anticuerpos y receptores estereoselectivos para ligandos específicos.
Una tercera aplicación de la reactividad de los restos laterales de los aminoácidos está en identificar el tipo de aminoácidos involucrados directamente en cierta funcion de una proteínas. Así. por ejemplo, si un residuo de cisteína participa en el reconocimiento de un ligando específico, al modificar este residuo con metil-metano-tiosulfonato, la proteína pierde su actividad biológica. En cambio, si el metil-metano-tiosulfonato se añade cuando el ligando está presente, la presencia del ligando protege a la cisteína con la que interactúa y evita la pérdida de la función.
Además, las propiedades químicas de los aminoácidos ciertamente son aprovechadas por los sistemas vivos para realizar diferentes funciones (ver ejemplos).
Métodos de cuantificación
Los aminoácidos pueden cuantificarse mediante la reacción del grupo α-amino con ninhidrina. Este compuesto reacciona rápidamente con el grupo amino, lo oxida y libera amonio, el cual se condensa con la ninhidrina reducida y con otra molécula de ninhidrina para producir un aducto púrpura.
|
|
Separación y análisis de mezclas de aminoácidos
A menudo se tienen mezclas de aminoácidos que se desean analizar. Antes de poder cuantificar estas mezclas es necesario separarlas. Tres métodos de separación han sido frecuentemente empleados en los laboratorios:
Cromatografía de capa fina. Este método se basa en la separación de las moléculas adsorbidas a una capa muy delgada de gel de sílice, mediante el flujo de una columna de solvente que se deja ascender mediante capilaridad. La separación se realiza en base a la polaridad de las moléculas y la mezcla de solventes más empleada ha sido butanol:agua:ac. acético (4:1:1, más detalles).
Cromatografía líquida en columnas de intercambio aniónico. En este caso, los aminoácidos se hacen pasar por una columna de resina con un grupo catiónico. Los aminoácidos, según su carga se van a unir a la columna y luego, mediante un cambio gradual en el pH del solvente que se aplica a la columna, se va eluyendo cada aminoácido a un pH distinto (según su punto isoeléctrico). Como algunos aminoácidos son más dificiles de separar que otros, a menudo es necesario emplear una columna corta para separar un grupo de aminoácidos y una columna larga para separar los aminoácidos restantes (más detalles).
Cromatografía líquida de alta resolución en columnas de fase reversa. Este método consiste en aplicar los aminoácidos disueltos en una fase acuosa acidificada a una columna de sílice unida a una cadena hidrocarbonada. Los aminoácidos, segun su polaridad se van a unir a la columna y entonces el eluyente se mezcla gradualmente con cantidades cada vez mayores de un solvente menos polar que el agua. Los aminoácidos van siendo lavados de la columna conforme la polaridad del solvente baja lo suficiente (más detalles y un cromatograma).
Los aminoácidos pueden identificarse mediante su reacción con ninhidrina, mediante su absorbencia UV o mediante fluorescencia (si están marcados con un grupo fluorescente), ya sea en la placa de sílice, o conforme eluyen de la columna.
(Clasificación de los aminoácidos)