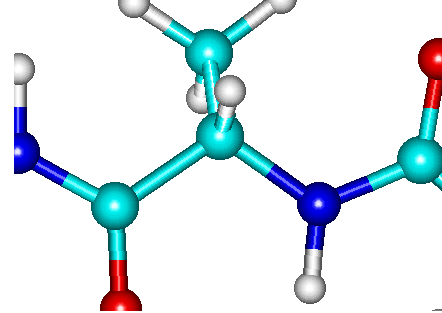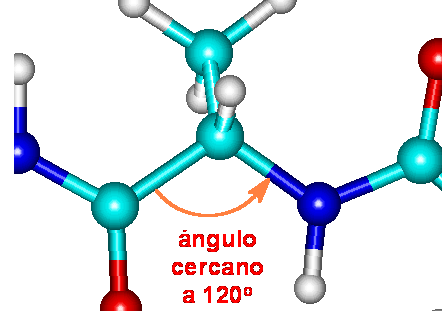
Las proteínas constan de un esqueleto formado por la secuencia
repetida de los grupos nitrógeno-carbono alfa y carbonilo.
Los enlaces que se forman y la secuencia de restos de aminoácidos
que forman cada proteína se conocen como su estructura a nivel primario.
El esqueleto central es semejante en todas las proteínas y,
por tanto, el problema de como darle forma en el espacio tiene aspectos
que son comunes a todas las proteínas. Este problema puede abordarse
con énfasis en el plegamiento de un cada resto de aminoácido
respecto de sus vecinos cercanos, lo que nos da una idea de los acomodos
locales de los átomos, a este nivel de organización local
se le conoce como la estructura de
nivel secundario de la proteína y en este nivel de
análisis nos ocuparemos más de como una resto de aminoácido
queda orientado respecto al que le precede y al que le sigue, más
de que si hay o no contactos con regiones alejadas de la proteína.
Especialmente, a este nivel, veremos a los substituyentes laterales del
carbono alfa (grupos R) como bultos, sin ocuparnos demasiado de lo que
les rodea y de si forman o no enlaces débiles con otras regiones
de la proteína.
El esqueleto covalente de una proteína posee una secuencia
de enlaces que restringe de modo importante su mobilidad, a diferencia
de otros polímeros.
En la secuencia de átomos -N-C(alfa)-CO(carbonilo)-N-C(alfa)-CO(carbonilo)-N-C(alfa)-CO(carbonilo)- que sigue la dirección natural de la cadena, tan
sólo los enlaces entre el N amídico y el C alfa son enlaces
sencillos que pueden rotar libremente alrrededor
de su eje.
La rotación de los ángulos, llamados Phi y Psi,
origina diversos ordenamientos espaciales, pero dichos arreglos sólo
son estables si los átomos que forman parte de la proteína
pueen acomodorse en el espacio permitiendo interacciones favorables. Así,
resulta un número pequeño de formas
en las que una proteína puede plegarse sin incurrir en distonciones
de la geometría natural de los enlaces peptídicos, o la de
los demás átomos de los aminoácidos.
Debido a que el carbono alfa es tetrahédrico, con los átomos
adyacentes en los cuatro vértices, los ángulos entre el amino
amídico y el carbono carbonílico son de 120o,
aproximadamente


O bien, si miran hacia lados totalmente opuestos
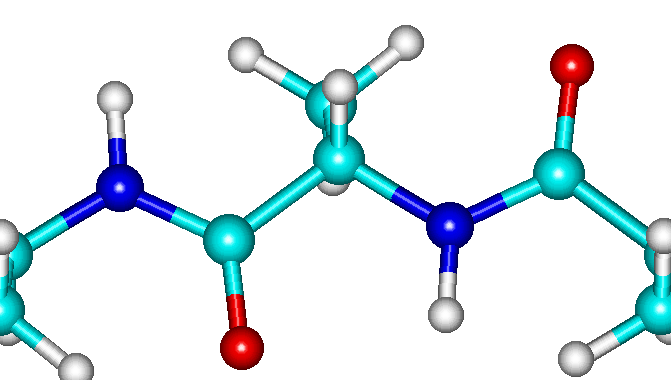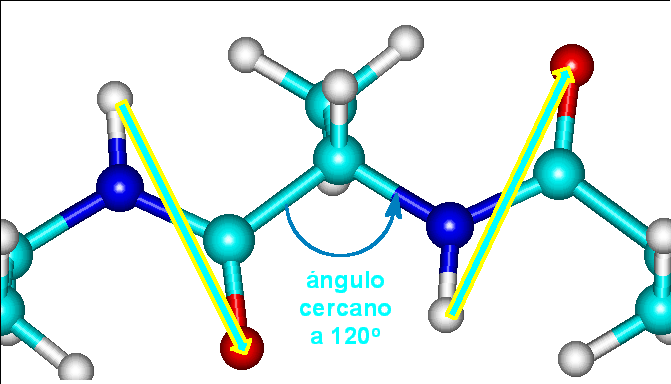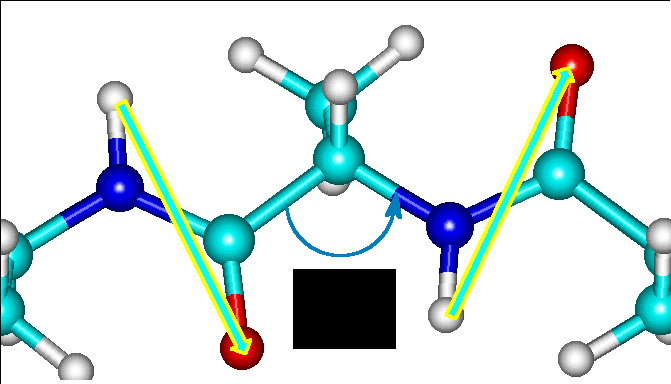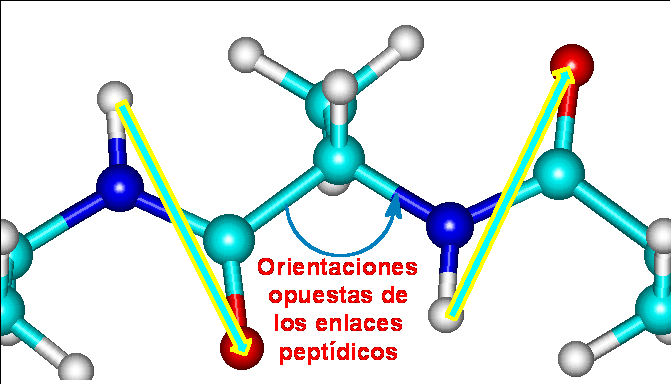
En el segundo caso, un enlace vería hacia el norte, otro al sur, otro al norte, etc. El resultado sería una alternancia de álgulos de 120o y -120o dando lugar a un plegamiento extendido en forma de acordeón, conocidas como LÁMINAS