(regresar a las propiedades del enlace peptídico)
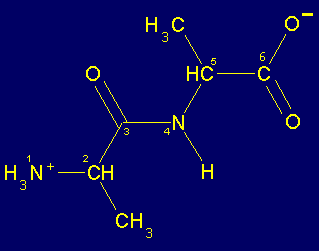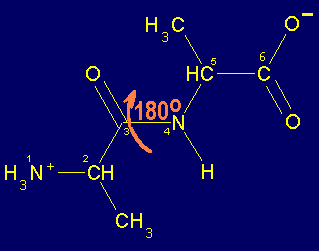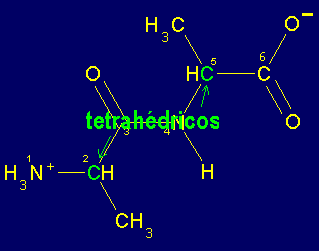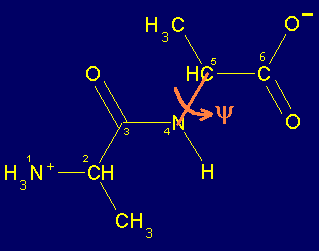
Geometría planar del enlace peptídico.
Debido a la presencia de formas resonantes del enlace peptídico:
Como el enlace el plano y no rota, los enlaces peptídicos pueden presentar isomería cis-trans.
En la imagen 3D del enlace peptídico se puede apreciar la planaridad del enlace peptídico y la geometría de los cuatro átomos que están unidos a él (dos carbonos a, el oxígeno del carbonilo y el hidrógeno del amino)
Enlaces flexibles y enlaces rígidos en un dipéptido.
El esqueleto base de un dipéptido está definido por la secuencia de átomos (H3+N)-Ca1-CO-NH-Ca2-(COOH). Como ya se ha mencionado los cuatro átomos Ca1CNCa2 (átomos 2,3,4 y 5 en la figura que sigue al párrafo) están en un mismo plano y el enlace peptídico no puede girar. Por tanto, el enlace peptídico presenta ángulos de enlace cercanos a 120o (por ejemplo el águlo formado por los átomos 1,2 y 3 o 4,5 y 6 en la figura) y el ángulo dihedro formado por los cuatro átomos Ca1CNCa2 (átomos 2,3,4 y 5) es de 180o (configuración trans, ocasionalmente puede ser 0o , es decir cis cuando los átomos 2 y 5 están del mismo lado del enlace 3-4). La prolina es el único aminoácido que, con una frecuencia semejante, se presenta en enlaces peptídicos tanto cis , como trans . En los demás aminoácidos, el enlace peptídico trans está muy favorecido y son raros los enlaces en cis.

Sin embargo, los Ca son tetrahédricos y por lo tanto los enlaces entre el Ca1CO (enlace 2-3), entre el Ca1R (2-metileno), entre Ca1N+H3 (1-2) , entre NHCa2 (4-5), entre Ca2R (5-metileno) y entre Ca2COOH (5-6) pueden rotar libremente. El ángulo dihedro formado por los átomos 1,2,3 y 4 de la figura se denomina y (psi) y el formado por los átomos 3,4,5 y 6 se denomina f (phi). La posición de estos átomos determina la dirección que la cadena principal (átomos numerados) adopta fuera del pláno de la figura anterior. Es decir la estructura tridimensional del dipéptido. Por convensión, estos ángulos se consideran 0o cuando los átomos vecinos equivalentes se encuentran en el mismo plano y en un mismo lado del enlace. A partir de dicha posición y colocando el carbono frente a uno, un giro en el sentido de las manecillas del reloj se considera positivo y en el sentido opuesto dará lugar a ángulos negativos. Así, los ángulos varían entre -180 y 180o.
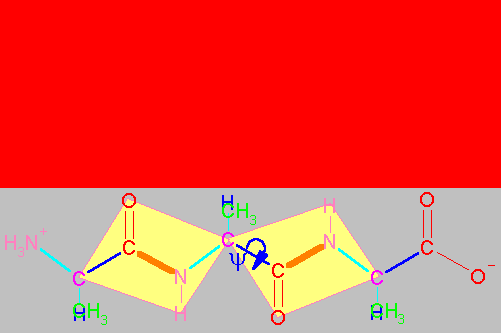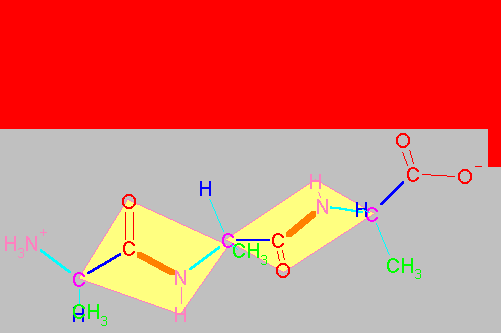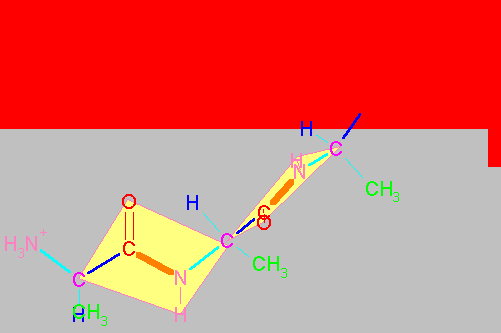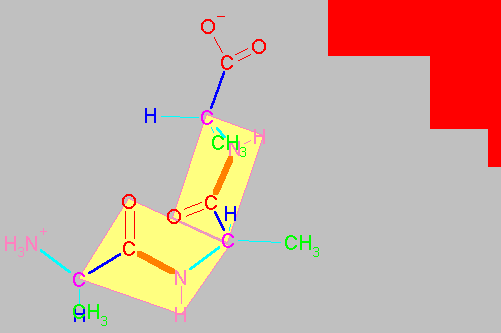
"Espacio conformacional" de un dipétido.
El cuidadoso balance entre enlaces planos rígidos y enlaces tetrahédricos que pueden rotar, mismos que se alternan en el esqueleto de un péptido, convierten al péptido en una estructura con una flexibilidad limitada. Esta flexibilidad limitada está además restringida por los impedimentos estéricos que se generan cuando los ángulos dihedros f y y adoptan posiciones en las que los átomos cercanos chocan unos con otros. Esto significa que de todas las posibles combinaciones de pares de ángulos (f, y) que existen (3602 = 129600 si se asume que la diferencia mínima entre dos posiciones distintas es de 1o) menos del 20% de ellas son físicamente posibles. Aún en el caso del dipéptido G-G, que no posee cadenas laterales, menos del 50% de las conformaciones son estables.
Si tomamos dos ejes coordenados que representen las posiciones de los ángulos dihedros f y y, para representar con un punto cada par de ángulos que resultan en una conformación no impedida, el mapa resultante se denomina mapa de Ramachandra.
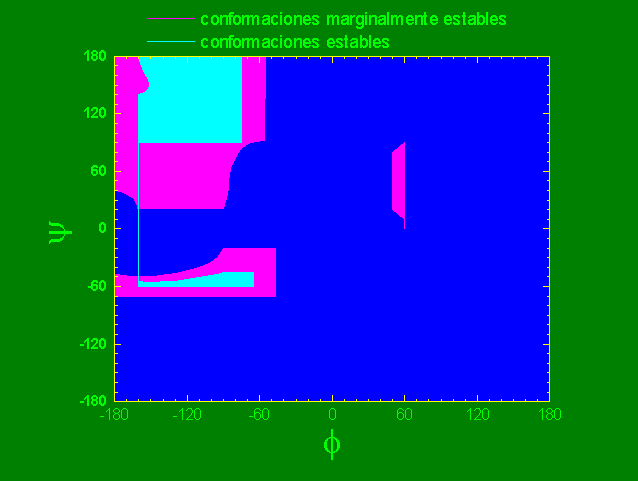
Mapa de Ramachandra de un dipéptido con grupos R de tamaño promedio.
Las limitadas conformaciones que puede adoptar un péptido en el espacio juegan un papel muy importante en la estabilidad de la estructura tridimensional de las proteínas, ya que una vez que los distintos aminoácidos adoptan una cierta conformación, existen serias barreras energéticas para que la conformación se modifique. Así, como veremos en los siguientes apartados, las fuerza débiles que se establecen entre los distintos grupos químicos de un péptido son suficientes para mantener la conformación de una proteína en un rango de condiciones de salinidad, pH y temperatura que resulta muy amplio cuando se le compara con la estabilidad de otros polímeros naturales y sintéticos.
| (Índice) | (créditos) | (Aminoácidos) | (Anatomía...) |